
Kalsiyumun Moleküler Yapısı Nasıldır?
Kalsiyum, doğada yaygın olarak bulunan ve biyolojik süreçlerde önemli rol oynayan bir alkali toprak metalidir. Moleküler yapısı, çeşitli bileşikler oluşturma kapasitesi ve fiziksel özellikleri ile dikkat çeker. Sağlık açısından kemik sağlığı, kas fonksiyonu ve sinir iletimi için kritik öneme sahiptir.
Kalsiyum, periyodik cetvelin 2A grubunda yer alan bir alkali toprak metalidir. Atom numarası 20 olan kalsiyum, doğada yaygın olarak bulunan ve birçok biyolojik süreçte önemli rol oynayan bir elementtir. Kalsiyum, genellikle kalsiyum karbonat (CaCO₃) gibi bileşikler veya serbest metal formunda bulunabilir. Bu makalede, kalsiyumun moleküler yapısı, özellikleri ve önemi detaylı olarak ele alınacaktır. Kalsiyumun Atomik Yapısı Kalsiyum atomu, 20 proton, 20 elektron ve genellikle 20 nötron içerir. Atomik yapısı, çekirdek etrafında dönen elektronların belirli enerji seviyelerinde düzenlenmesi ile karakterizedir. Kalsiyum atomunun elektron konfigürasyonu şu şekildedir:
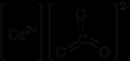
Bu yapı, kalsiyumun periyodik cetveldeki konumuna ve kimyasal özelliklerine ışık tutar. Kalsiyum, dış orbitinde iki elektron bulundurması nedeniyle kolayca pozitif iyon (Ca²⁺) haline gelir. Bu özellik, kalsiyumun birçok bileşik oluşturmasını sağlar. Kalsiyumun Moleküler Bileşikleri Kalsiyum, çeşitli bileşikler oluşturma kapasitesine sahip bir elementtir. Kalsiyum bileşikleri, genellikle iyonik bağlarla bir araya gelir. Kalsiyumun en yaygın bileşikleri şunlardır:
Bu bileşiklerin her biri, kalsiyum atomunun moleküler yapıdaki rolünü ve bu yapıların fiziksel ve kimyasal özelliklerini belirler. Kalsiyumun Fiziksel ve Kimyasal Özellikleri Kalsiyum, gümüş-beyaz renkte, hafif ve sert bir metal olup, melting point (erime noktası) 842 °C ve boiling point (kaynama noktası) 1484 °C'dir. Kalsiyum, su ile tepkimeye girerek hidrojen gazı ve kalsiyum hidroksit oluşturur. Kalsiyumun bazı kimyasal özellikleri şunlardır:
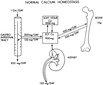
Bu özellikler, kalsiyumun endüstriyel ve biyolojik uygulamalardaki önemini artırmaktadır. Kalsiyumun Biyolojik Önemi Kalsiyum, canlı organizmalarda birçok hayati işlevde kritik bir rol oynamaktadır. İnsan vücudunda kalsiyum, kemiklerin ve dişlerin yapısal bütünlüğünü sağlamakta, kas kasılmalarında, sinir iletiminde ve kan pıhtılaşmasında önemli bir yer tutmaktadır. Kalsiyumun biyolojik önemi şu şekillerde özetlenebilir:
Kalsiyum eksikliği, osteoporoz, kas spazmları ve sinir sistemi bozuklukları gibi sağlık sorunlarına yol açabileceğinden, yeterli alımının sağlanması önemlidir. Sonuç Kalsiyum, hem fiziksel hem de kimyasal özellikleri ile birçok alanda önemli bir elementtir. Moleküler yapısı, onun çeşitli bileşikler oluşturabilme yeteneği ile birleşerek, hem endüstriyel hem de biyolojik süreçlerde kritik bir rol oynamaktadır. Kalsiyumun yeterli alımı, insan sağlığı için vazgeçilmezdir. Gelecekte kalsiyum ile ilgili araştırmalar, bu elementin yeni uygulamalarını ve sağlık üzerindeki etkilerini daha da derinlemesine incelemeye devam edecektir. |





.webp)































Kalsiyumun moleküler yapısı ve biyolojik önemi üzerine bu detaylı bilgiye ulaşmak oldukça ilginç. Kalsiyum atomunun dizi elektron konfigürasyonu ile pozitif iyon haline gelme yeteneği, kimyasal tepkimelerdeki rolünü nasıl etkiliyor? Ayrıca, kalsiyum eksikliğinin sağlık üzerindeki etkileri oldukça ciddi görünüyor. Sizce, günlük kalsiyum alımının artırılması için hangi doğal kaynaklar en etkili olabilir?
Kalsiyumun Moleküler Yapısı ve Biyolojik Önemi
Kalsiyum, periyodik tabloda alkali toprak metallerinden biridir ve atom numarası 20'dir. Elektron konfigürasyonu 1s² 2s² 2p⁶ 3s² 3p⁶ 4s² şeklindedir. Kalsiyum, dış enerji seviyesindeki iki elektronunu kolayca kaybederek pozitif iyon (Ca²⁺) haline gelir. Bu özellik, kalsiyumun kimyasal tepkimelerde reaktif bir element olmasını sağlar ve özellikle biyolojik sistemlerde önemli roller üstlenir. Kalsiyum, hücre sinyal iletiminde, kas kasılmalarında ve kan pıhtılaşmasında kritik bir bileşendir.
Kalsiyum Eksikliğinin Sağlık Üzerindeki Etkileri
Kalsiyum eksikliği, kemik sağlığını olumsuz etkileyerek osteoporoz gibi hastalıklara yol açabilir. Ayrıca, kas krampı, yorgunluk ve kalp ritmi bozuklukları gibi belirtiler de görülebilir. Bu nedenle, yeterli kalsiyum alımı sağlıklı bir yaşam için son derece önemlidir.
Doğal Kaynaklar ve Günlük Kalsiyum Alımının Artırılması
Günlük kalsiyum alımını artırmak için etkili doğal kaynaklar arasında süt ve süt ürünleri (yoğurt, peynir), yeşil yapraklı sebzeler (brokoli, ıspanak), kuruyemişler (badem), balık (özellikle sardalya ve somon) ve kalsiyum ile zenginleştirilmiş gıdalar (örneğin bazı tahıllar) bulunmaktadır. Bu gıdaların düzenli olarak tüketilmesi, kalsiyum ihtiyacını karşılamaya yardımcı olabilir.